


癌症診斷需時,需要準確的判斷力,然而本港醫護人手不足,如何在應付日常繁重的工作下,令癌症患者能夠及時就診,成為本港醫院恆常的挑戰。
面對這一困境,全新人工智能(AI)診斷系統SmartPath應運而生。SmartPath由香港科技大學開發、在廣州南方醫院做前瞻性臨床驗證,項目團隊負責人日前接受《大公報》專訪時介紹,SmartPath在癌症診斷的術前、術中和術後診斷中表現出0.98-0.99的高準確度;且該AI模型完成一次診斷僅需約一分鐘,相較原先幾分鐘至十幾分鐘的人工診斷時間,效率大幅提升。團隊希望半年至一年後,能令SmartPath市場化。\大公報記者 邱梓茵、湯嘉平(文) 林少權(圖)
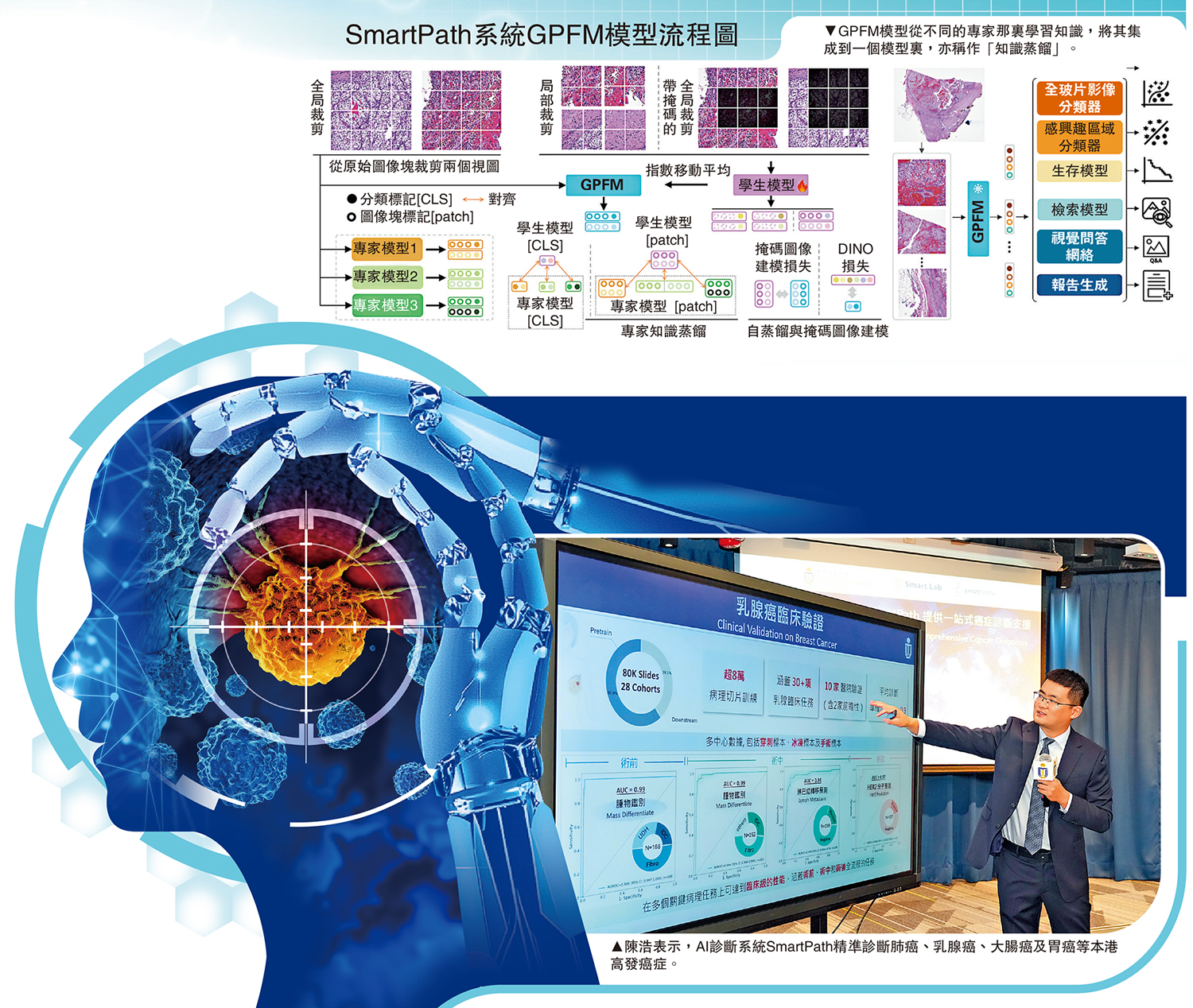
SmartPath系統研發者、香港科技大學計算機科學及工程學系和化學及生物工程學系助理教授兼醫工交叉聯合創新中心主任陳浩介紹,該系統建基於全球規模最大、種類最多元的病理數據庫之一,涵蓋34個主要人體組織部位,收錄逾50萬張全切片影像。系統可協助醫護人員完成逾百項臨床任務,包括癌症分級分型、治療反應評估、存活率預測及生成病理報告,並實現關鍵突破:透過綜合病理基礎模型框架,精準診斷肺癌、乳腺癌、大腸癌及胃癌等高發癌症。「在眾多檢查方法中,組織病理學檢查是癌症診斷的金標準,可用於最終診斷及指導治療。」陳浩說道。
病理數據全球規模最大
SmartPath的核心技術由GPFM與mSTAR兩大AI模型協同驅動。病理診斷本質上是對切片影像的精讀,GPFM如同顯微鏡下的「導航員」,能將複雜視覺信號轉化為可判讀的線索。為訓練此模型,研發團隊與南方醫科大學梁莉教授等臨床專家共建約10萬張病理切片的「圖譜級」資料庫,覆蓋術前活檢診斷、術中切緣判斷及術後評估三大關鍵場景,實現診療全流程覆蓋。
陳浩進一步解釋,GPFM模型採用「知識蒸餾」技術(見SmartPath系統GPFM模型流程圖),其中「教師模型」如資深病理專家,能全面預測並標註病變類型與概率;「學生模型」則如初入行的年輕醫生,透過學習教師模型的診斷思路,掌握數據規律並提升判斷能力。此方法不僅提高模型的泛化能力,使其在未見過的病人數據上表現更佳,還能加速訓練過程,提升效率。
為應對複雜的癌症診斷需求,團隊另研發多模態基礎模型mSTAR。該模型如同「綜合診斷專家」,不僅能解讀病理切片的視覺信息,更能融合病理報告、基因分子數據等多元信息,透過「多模態知識增強」技術形成完整診斷依據。陳浩強調:「mSTAR是全球首個多模態知識增強的泛癌病理基礎大模型。」該模型大幅擴展應用場景,涵蓋癌症診斷及預後評估等多項臨床任務。
SmartPath在完成開發後、大規模試用前進行了前瞻性臨床驗證,以評估其穩定性與臨床適用性。參與驗證的南方醫院病理科主任、南方醫科大學基礎醫學院病理學系教授梁莉指出,該系統在術前、術中和術後診斷中均表現高準確度,接近「零誤判」。陳浩也表示,正持續納入多樣化數據,以適應各地不同的臨床需求。
與內地多家重點醫院合作
在術前診斷方面,系統良惡性分類的AUC值高達0.99,幾乎無誤判。梁莉表示,AI模型完成一次診斷僅需約1分鐘,相比傳統人工分析,效率顯著提升,有助於縮短患者等待時間,並降低不必要的手術風險。
術中冰凍診斷要求在30分鐘內出具結果,直接影響手術方案。驗證中,AI系統對術中冰凍標本的良惡性分類準確度達0.99,診斷時間縮短30%以上,有助於醫生優化手術決策,降低因診斷延誤或偏差帶來的風險。
針對術後標本,系統進一步擴展應用,涵蓋腫瘤分型、分子標誌物預測、淋巴結轉移判斷及癌栓檢測等多項任務。在肺癌原發與轉移灶的鑒別及來源預測中,分類準確度達0.98。臨床數據顯示,系統可將醫生診斷精準度提升10%以上,在複雜病例中尤其能夠減輕醫生負擔,降低人為誤差。
陳浩補充,研發與驗證階段已與全國上百家醫院合作,其中十餘家重點醫院參與了回顧性與前瞻性研究,覆蓋多個省份與醫療體系。他強調,聯動不同區域醫院的核心目的,是納入多樣化人口結構與病例數據,以確保AI模型在後續推廣中更好地適應各地臨床實驗。